Modifikasi Kimia SOD pada Lipid
Peroksidasi dan Antioksidan pada Tikus Diabetes
Nur Lailah
Jurusan Kimia, Fakultas Matematika
dan Ilmu Pengetahuan Alam
Universitas Brawijaya
Universitas Brawijaya
REVIEW from
2. Hasil dan Pembahasan
1.
Pendahuluan
Diabetes
mellitus (DM) didefinisikan sebagai gangguan metabolisme kronis. DM
mempengaruhi lebih dari 346 juta orang di seluruh dunia dan jumlah ini
diperkirakan akan meningkat dua kalinya pada tahun 2030 [1,2]. Beberapa penelitian menunjukkan bahwa generasi spesies
oksigen reaktif dan radikal bebas meningkat dan/atau menurunnya potensi
pertahanan antioksidan dalam pasien dengan diabetes mellitus [2,3].. Penelitian lain menunjukkan
bahwa DM berhubungan dengan stres oksidatif, yang menyebabkan peningkatan produksi
spesies oksigen reaktif (ROS), termasuk hidrogen peroksida (H2O2),
radikal superoksida (O2• -), dan radikal hidroksil (OH•)
atau pengurangan sistem pertahanan antioksidan [2,4].. Keseimbangan antara generasi radikal dan sistem radikal
sangat penting dalam DM [5].
SOD,
Cu, Zn jenis [EC 1.15.1.1] mengkatalisis dismutasi anion superoksida radikal (O2•-)
yang sangat reaktif untuk menjadi molekul oksigen (O2) dan hidrogen
peroksida (H2O2), yang kemudian dikonversi menjadi
molekul oksigen dan air dengan enzim katalase [6,7].Telah lama diketahui bahwa spesies oksigen reaktif yang
berlebihan dapat menyebabkan penyakit kanker, diabetes dan penyakit inflamasi,
serta berbagai penyakit kardiovaskular [8,9].
Enzim SOD sangat penting dalam menurunkan radikal superoksida dan karenanya
dapat membantu melindungi sel-sel terhadap produk sampingan yang beracun dari
metabolisme aerobik. Namun, SOD memiliki plasma waktu paruh yang pendek pada in
vivo (kurang dari 5 menit) hal ini akan membatasi aplikasi klinis dari enzim
ini [10,12]. Selain itu, SOD dengan
cepat dinonaktifkan oleh produk reaktifnya sendiri H2O2,
dan menghasilkan ROS yang sangat reaktif [10,13].
Berbagai
strategi telah dikembangkan untuk meningkatkan intravaskular waktu paruh SOD [6,8,10–12,14–15]. Dikarenakan profil
farmakokinetik yang rendah [11,12,16], dan
waktu paruh yang pendek dalam sistem biologi [17], pengendalian pengiriman strategi baru telah diteliti.
Transformasi kimia pada permukaan protein dengan pelarut air polimer sintetis
telah dilaporkan sebagai pendekatan yang berguna untuk meningkatkan sifat
farmakologi dan farmakokinetik SOD [15].
Berbagai polimer alami dan sintetis telah digunakan sebagai agen kimia untuk
memodifikasi protein [18] dan enzim
antioksidan. Beberapa konjugat Cu, Zn-SOD dikembangkan termasuk poli
(vinlypyrrolidone) (PVP), polietilen glikol (PEG), karboksimetilselulosa (CMC),
CM-dekstran, DIVEMA (divinly eter dan maleat anhyride), poli [N
(2hydroxypropyl) metakrilamida) (PHPMA) [11,19,20]
dalam literatur.
Bagaimanapun,
pengaruh modifikasi kimia SOD dengan poly metil vinil eter-co-maleat anhidrida
(PMVE / MA) dan CMC polymers belum dilaporkan terhadap tikus diabetes yang
diinduksi streptozotocin. PMVE / MA memiliki potensi besar dalam aplikasi
biomedis karena sifat-sifatnya yang biodegradable dan biokompatibel [21]. Demikian pula, CMC adalah polimer
anionik alami yang biodegradable dan biocompatible [22] dan memiliki beberapa potensi dalam aplikasi ilmu pengetahuan
biomedis [23].
2. Hasil dan Pembahasan
Penelitian
ini didesain untuk membandingkan efek SOD yang asli dan SOD yang dimodifikasi
secara kimia dengan polimer pada peroksidasi lipid dan status antioksidan pada
tikus diabetes yang diinduksi dengan STZ.
2.1.
Karakterisasi konjugat SOD-CMC dan SOD-PMVE / MA dengan kromatografi eksklusi ukuran
Prosedur
konjugasi carbodiimide diikuti dengan
konjugat-polimer untuk memperoleh konjugat polimer SOD seperti yang dijelaskan
sebelumnya. SOD-PMVE/MA atau SOD-CMC kemudian dikonjugasi pada rasio berat
polimer yang berbeda/SOD 16, 24, 32 menggunakan EDC yang larut dalam air
sebagai zero-lengthcross-linker.
Semua
konjugat yang dikarakterisasi dengan SEC bertujuan untuk mengidentifikasi
apakah konjugasi terjadi secara sempurna. Informasi rinci konjugat polimer SOD
tentang sifat-sifat fisikokimia diperoleh menggunakan detektor SEC, RI dan RALS
yang sensitif terhadap masing-masing konsentrasi dan massa molar, sedangkan
detektor absorbansi UV sensitif terhadap kandungan protein sampel [24]. Kromatogram SEC dari SOD dan
konjugat polimer SOD dengan PMVE/MA (Gambar 2.1) dan CMC (Gambar 2.2)
menunjukkan konsentrasi SOD yang sama sebesar 2,5 mg/mL dalam semua larutan. Pada
Gambar.2.1, konjugat SOD-PMVE/MA (1, 2 atau 3) dan SOD dalam sistem (5) diberi
label pada kromatogram SEC. Sebagaimana ditunjukkan pada Gambar 2.1, semua kromatogram SOD yang diperoleh dari detektor
yang berbeda, puncak elusi pada 18,27 mL disebabkan adanya SOD. Ketika reaksi
konjugasi terjadi, ada puncak baru muncul (1, 2 atau 3) yang dielusi antara 10 dan 17,5 mL dan dideteksi dengan
detektor UV (Gambar 2.1 B). Hal ini menunjukkan bahwa konjugasi antara gugus
karboksil PMVE/MA dan gugus amino dari enzim SOD terjadi secara sempurna.
Pada
Gambar 2.2 hasil yang sama untuk konjugasi CMC-SOD diperoleh dari analisis SEC.
Sebagai hasil reaksi konjugasi, molekul yang lebih besar (konjugat SOD-CMC)
disintesis dan molekul-molekul dielusi dari kolom lebih awal dari pada molekul
CMC dan SOD seperti yang terlihat pada Gambar 2.2B.
Berdasarkan
Gambar. 1 dan 2, nilai luas puncak yang diperoleh dengan detektor UV, RI dan
RALS jelas meningkat dengan meningkatnya perbandingan berat molekul polimer/SOD
(16, 24, 32). Sinyal RI semua molekul berbanding lurus dengan dn/dc dan konsentrasi.
Nilai polimer dn/dc umumnya terkait dengan komposisi kimianya. Nilai dn/dc
polimer adalah secara umum berhubungan dengan komposisi kimianya. Dalam
kromatogram RALS, daerah puncak konjugat meningkat dengan meningkatnya
konsentrasi polimer yang digunakan dalam reaksi konjugasi, seperti yang
terlihat pada Gambar 2.1 C dan 2.2 C. Sinyal hamburan cahaya berhubungan dengan
berat molekul dan konsentrasi molekul dan peningkatan dalam daerah puncak
kromatogram RALS merupakan modifikasi SOD dengan PMVE/MA atau CMC secara kimia.
SOD adalah enzim pelindung penting yang mempercepat dismutasi radikal anion superoksida menjadi hidrogen peroksida sebagai pertahanan utama [5]. Tetapi tidak ada penurunan di tingkat enzim antioksidan di banyak organ pada tikus diabetes [26]. Meskipun beberapa penelitian melaporkan penurunan aktivitas enzim SOD pada diabetes mellitus [28,29], beberapa penelitian lain menunjukkan peningkatan aktivitas enzim ini pada tikus diabetes yang diinduksi STZ [30,31]. Keseimbangan antara oksidan dan antioksidan sistem sangat penting dalam patogenesis diabetes mellitus dan pada perkembangan cedera jaringan.
Gambar
2.1 SOD-PMVE/MA Konjugasi
Gambar
2.2 SOD-CMC Konjugasi
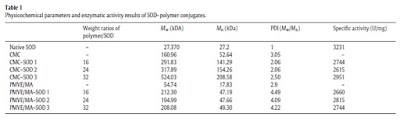
Selain
itu, kami meneliti efek dari modifikasi kimia SOD pada aktivitas tertentu
menggunakan metode xanthine oksidase dan xanthine dan hasil yang diperoleh ditunjukkan
pada Tabel 1. Mengenai hasil
aktivitas spesifik; diamati bahwa aktivitas enzimatik konjugat SOD-polimer adalah
kurang dari SOD : SOD-PMVE/MA tetap 87,12% dari aktivitas SOD asli, sedangkan
SOD-CMC mempertahankan 91,3% aktivitas spesifik konjugat sangat maksimal dibandingkan
dengan SOD asli.
2.2.
Stabilitas Konjugat SOD-CMC dan SOD-PMVE /MA
Dalam
penelitian ini, stabilitas enzim konjugat PMVE/MA-SOD dan CMC-SOD terhadap suhu
atau H2O2 yang ditambahkan secara eksternal diuji.
Stabilitas suhu SOD adan SOD yang dimodifikasi secara kimia ditentukan dari 40
sampai 95ºC selama 5 menit (Gambar 2.3A). Kedua konjugat PMVE/MA-SOD
dan CMC-SOD menunjukkan stabilitas suhu yang lebih baik daripada SOD.
Terhadap
stabilitas
eksternal ditambahkan 0,4 mM H2O2 menunjukkan Gambar 2.3B.
Sebagian besar konjugasi polimer SOD menjadi lebih stabil terhadap H2O2
dari SOD; kecuali konjugat SOD-CMC yang memiliki perbandingan berat molekul 16
dan 24. Menurut hasil ini, kita dapat mengasumsikan bahwa konjugat PMVE/MA-SOD
lebih stabil daripada konjugat SOD-CMC terhadap H2O2 yang
ditambahkan secara eksternal.
Gambar
2.3 Kestabilan Enzim SOD Native dan SOD Konjugasi Polimer
2.3
Pengaruh konjugat SOD-CMC dan PMVEMA-SOD pada Kadar MDA dalam jaringan otak,
ginjal dan hati
Seperti
dilihat pada Tabel 2, tingkat MDA meningkat di otak, ginjal dan hati pada tikus
kontrol diabetes (Grup II) bila dibandingkan dengan kontrol normal (kelompok I)
dan SOD asli (Kelompok III) atau konjugat SOD ( Kelompok IV dan V) pada keompok
yang diterapi (p <0,016). Konsentrasi produk peroksidasi lipid dalam
jaringan, yang merupakan produksi tidak langsung radikal bebas yang berlebihan,
meningkat pada tikus diabetes yang diinduksi STZ [2,25–27]. Selanjutnya peningkatan kadar MDA yang sesuai dengan
hasil penelitian sebelumnya dalam literatur [26,27]. Dengan demikian, tingkat MDA meningkat pada diabetes melitus
menunjukkan bahwa hiperglikemia menginduksi reaksi lipid peroksidasi[26,27]..
Namun, pengobatan dengan konjugat SOD-PMVE/MA secara signifikan (p <0,01) menurunakan
kadar MDA bila dibandingkan dengan kontrol kedua (kelompok I dan II), kelompok native
dan konjugat CMC-SOD (Kelompok III, IV) pada jaringan otak.
Pengobatan
dengan konjugat PMVE/MA-SOD memiliki efek yang terbaik dari kadar MDA pada tikus
diabetes yang diinduksi dengan STZ pada otak, ginjal dan hati bila dibandingkan
dengan kelompok kontrol diabetes (Group II) (p <0,01, p <0,004 dan p <0,004,
masing-masing). Oleh karena itu, kita dapat mengatakan bahwa SOD yang dimodifikasi
secara kimia dengan PMVE/MA mampu mencegah peroksidasi lipid pada tikus
diabetes yang dinduksi dengan STZ pada otak, ginjal dan hati. Konjugat PMVE/MA-SOD
bisa dijadikan sebagai obat terapi baru untuk cedera peroksidasi lipid.
2.4.
Pengaruh konjugat SOD-CMC dan PMVE/MA-SOD terhadap Kadar GSH dalam jaringan
otak, ginjal dan hati
Tingkat
antioksidan non-enzimatik (GSH) dalam otak, ginjal dan hati ditunjukkan pada
Tabel 3. Dapat dilihat bahwa kadar GSH secara signifikan menurun pada tikus
diabetes yang diinduksi dengan STZ bila dibandingkan dengan tikus kontrol
normal. Aktivitas GSH dari kelompok SOD yang diterapi dengan dimodifikasi
secara kimia secara signifikan lebih tinggi dibandingkan pada kedua kelompok
kontrol (Grup I dan II) (p <0,004, p <0,004) tikus diabetes. Akan tetapi,
tidak ada pengaruh yang signifikan dari konjugat PMVE/MA-SOD atau CMC-SOD dalam
jaringan otak. Aktivitas GSH meningkat mungkin sebagai respon adaptif terhadap
stres oksidatif yang meningkat pada tikus diabetes yang diinduksi STZ [49]. Pada pemberian polimer-SOD kadar MDA
menurun dan tingkat GSH meningkat. Hal ini menunjukkan bahwa dengan adanya SOD yang
dimodifikasi secara kimia memiliki efek perlindungan dalam pengembangan
komplikasi stres oksidatif.
2.5.
Pengaruh konjugat SOD-CMC dan PMVE / MA-SOD pada tingkat SOD di otak, ginjal
dan jaringan hati
Tabel
4 menunjukkan aktivitas enzim antioksidan (SOD) dalam tikus diabetes yang dinduksi dengan STZ pada otak, ginjal dan
hati. Dalam kelompok kontrol diabetes (Grup II) aktivitas SOD otak secara
signifikan menurun bila dibandingkan dengan kelompok kontrol normal (p
<0,004), sedangkan tingkat aktivitas SOD hati meningkat. SOD native pada tikus
diabetes diterapi (Group III), kadar SOD ginjal dan hati secara signifikan
lebih tinggi dibandingkan kedua kelompok kontrol (p <0,004, keduanya). Juga,
pengobatan dengan konjugat SOD-CMC (Group IV) memiliki efek kadar SOD terbaik,
bila dibandingkan dengan kelompok tikus kontrol diabetes (Kelompok II) (p
<0,01, p <0,004 dan masing-masing p <0,004) tikus diabetes yang
diinduksi dengan STZ.
SOD adalah enzim pelindung penting yang mempercepat dismutasi radikal anion superoksida menjadi hidrogen peroksida sebagai pertahanan utama [5]. Tetapi tidak ada penurunan di tingkat enzim antioksidan di banyak organ pada tikus diabetes [26]. Meskipun beberapa penelitian melaporkan penurunan aktivitas enzim SOD pada diabetes mellitus [28,29], beberapa penelitian lain menunjukkan peningkatan aktivitas enzim ini pada tikus diabetes yang diinduksi STZ [30,31]. Keseimbangan antara oksidan dan antioksidan sistem sangat penting dalam patogenesis diabetes mellitus dan pada perkembangan cedera jaringan.
3. Kesimpulan
- Diabetes mellitus pada tikus adalah model yang berguna untuk mengamati efek perlindungan dari agen-agen yang diselidiki secara cepat pada kerusakan yang disebabkan oleh diabetes.
- Telah dijelaskan bahwa tingkat peroksidasi lipid dan stres antioksidan meningkat pada diabetes mellitus [26]. Penelitian ini merupakan studi pertama dari enzim SOD yang terkonjugasi dengan polimer PMVE/MA dan sifat fisikokimia konjugat ini dikarakterisasi denan kromatografi SEC.
- Selain itu, untuk pertama kalinya, konjugat SOD-CMC dan SOD-PMVE / MA digunakan terhadap komplikasi stres oksidatif pada diabetes mellitus. Hasil penelitian menunjukkan bahwa modifikasi kimia meningkatkan resistensi enzim terhadap suhu dan oksidatif dalam aktivasi oleh H2O2.
- . Pengobatan dengan SOD yang dimodifikasi secara kimia mengurangi tingkat peroksidasi lipid dan meningkatkan status antioksidan pada tikus diabetes yang dinduksi dengan STZ.
DAFTAR
PUSTAKA
[1] O. Egemen, O. Ozkaya, M.B.
Ozturk, E. Sen, M. Akan, D. Sakiz, C. Aygit, J. HandMicrosurg. 4 (2012) 60–64.
[2] V. Ramachandran, R. Saravanan,
J. Funct. Foods 5 (2013) 1077–1087.
[3] S. Rajasekaran, K. Sivagnanam,
S. Subramanian, Pharmacol. Rep. 57 (2005)90–96.
[4] M.M. Sklavos, S. Bertera, M.T.
Hubert, R. Bottino, J. He, J.N. Beilke,M.G. Coulombe, R.G. Gill, J.D. Crapo, M.
Trucco, Diabetes 59 (2010)1731–1738.
[5] E. Erarslan, C. Türkay, B. Uz,
A. Kaya, C. Koca, R. Bayrak, Ö. Alıcı, New J. Med. 27(2010) 106–112.
[6] Y. Kojima, A. Haruta, T. Imai,
M. Otagiri, H. Maeda, Bioconjug. Chem. 4 (1993)490–498.
[7] K.L. Brigham, Chest 89 (1986)
859–863.
[8] Z.J. Zhan, Z.G. Zhou, W.G.
Shan, Biochemistry (Moscow) 74 (2009)1266–1269.
[9] I.K. Adiga, R.R. Nair, Cell
Biochem. Funct. 26 (2008) 346–351.
[10] A. Dominguez, A. Valdivia, J.
Caballero, R. Villalonga, G. Martinez, E.H. Schacht,J. Bioact. Compat. Pol. 20
(2005) 557–570.
[11] V. Subr, T. Etrych, K.
Ulbrich, T. Hirano, T. Kondo, T. Todoroki, M. Jelinkova, B.Rihova, J. Bioact.
Compat. Pol. 17 (2002) 105–122.
[12] M.L. Corvo, J.C.S. Jorge, R.
van’t Hof, M.E.M. Cruz, D.J.A. Crommelin, G. Storm,Bba-Biomembranes 1564 (2002)
227–236.
[13] S.L. Jewett, A.M. Rocklin, M.
Ghanevati, J.M. Abel, J.A. Marach, Free Radic. Biol.Med. 26 (1999) 905–918.
[14] Y. Kojima, T. Akaike, K. Sato,
H. Maeda, T. Hirano, J. Bioact. Compat. Pol. 11(1996) 169–190.
[15] Y. Perez, A. Valdivia, L.
Gomez, B.K. Simpson, R. Villalonga, Macromol. Biosci. 5(2005) 1220–1225.
[16] G. Jadot, A. Vaille, J.
Maldonado, P. Vanelle, Clin. Pharmacokinet. 28 (1995)17–25.
[17] T. Kondo, H. Terajima, T.
Todoroki, T. Hirano, Y. Ito, T. Usia, K. Messmer, J. Surg.Res. 85 (1999) 26–36.
[18] K. Kizilbey, S. Derman, Z.
Mustafaeva, J. Chem. Soc. 35 (2013) 1191–1196.
[19] D. Oupick´y, K. Ulbrich,
B.ˇRíhová, J. Bioact. Compat. Pol. 14 (1999) 213–231.
[20] K. Ulbrich, J. Strohalm, D.
Plocová, D. Oupick´y, V. Subr, J. Soucek, P. Poucková, J.Matouˇsek, J. Bioact.
Compat. Pol. 15 (2000) 4–26.
[21] A.-Z. Chen, G.-Y. Wang, S.-B.
Wang, J.-G. Feng, Y.-G. Liu, Y.-Q. Kang, Materials 5(2012) 1841–1852.
[22] J. Liuyun, L. Yubao, X.
Chengdong, J. Biomed. Sci. 16 (2009) 65.
[23] A. Bajpai, A. Mishra, J.
Mater. Sci.: Mater. Med. 19 (2008) 2121–2130.
[24] H. Kong, J. Yang, Y. Zhang, Y.
Fang, K. Nishinari, G.O. Phillips, Int. J. Biol. Macro-mol. 65 (2014) 155–162.
[25] A. Maritim, R. Sanders, J.
Watkins III, J. Nutr. Biochem. 14 (2003)288–294.
[26] H.R. Yilmaz, E. Uz, N. Yucel,
I. Altuntas, N. Ozcelik, J. Biochem. Mol. Toxicol. 18(2004) 234–238.
[27] T. Hünkar, F. Aktan, A.
Ceylan, C. Karasu, Cell Biochem. Funct. 20 (2002)297–302.
[28] Y.G. Özkaya, A. Agar, P.
Yargic¸ oglu, G. Hacioglu, S. Bilmen-Sarikc¸ ioglu, I. Özen,Y. Alicigüzel,
Diabets Metab. 28 (2002) 377–384.
[29] S.A. Wohaieb, D.V. Godin,
Diabetes 36 (1987) 1014–1018.
[30] Y. Aliciguzel, I. Ozen, M.
Aslan, U. Karayalcin, J. Lab. Clin. Med. 142 (2003)172–177.
[31] W.-C. Huang, S.-W. Juang, I.
Liu, T.-C. Chi, J.-T. Cheng, Neurosci. Lett. 275 (1999)25–28.







Tidak ada komentar:
Posting Komentar